Extrait du site WEB Gep&CO (mai 2007)
Géochimie, Phytoplanton, et Couleur de l'Océan
GeP&CO
Méthodes de mesure dans GeP&CO :
Table des matières
II.- Conditions d'échantillonnage en mer
III.- Mesures de la concentration en sels nutritifs
IV.- Mesure de CO2 total et d'alcalinité
V.- Mesure des pigments photosynthétiques par HPLC
VI.- Mesure des pigments chlorophylliens par spectrofluorimetrie
VII.- Mesure de la phycoérythrine par spectrofluorimetrie
VIII.- Comptages de picoplancton par cytométrie en flux
IX.- Comptages de Coccolithophoridés
X.- Absorption de lumière par les algues
XI.- Absorption de lumière par la matière organique colorée dissoute (CDOM)
Le programme Géochimie, Phytoplancton et Couleur de l'Océan (GeP&CO) est un projet de trois ans dont l'objectif est de descrire et de comprendre la variabilité des populations de phytoplancton dans l'océan, et ses conséquences sur la géochemie de l'océan. GeP&CO fait partie du programme français Processus Océaniques et Flux (PROOF) soutenu par plusieurs instituts français : INSU/CNRS, IRD, CNES, et IFREMER. Les observations ont lieu chaque trimestre à travers l'Atlantique Nord, le long de la côte est des Etats Unis, à travers la Mer des Caraïbes jusqu'à Panama, et à travers le Pacifique équatorial et tropical sud jusqu'en Nouvelle Zélande et Nouvelle Calédonie. GeP&CO utilise les trajets commerciaux du navire de commerce Contship London, de la compagnie MS "Alexandra Rickmers" Schiffsbeteiligungsgesellschaft mbH & Co à Hambourg. La première campagne a eu lieu en novembre-décembre 1999, et la dernière s'est achevée en septembre 2002.
Les observations correspondent à trois principales catégories d'objectifs. La caractérisation des populations de phytoplancton fait principalement appel aux déterminations de pigments photosynthétiques, et aussi à des comptages de cellules automatiques par cytométrie en flux, ou au microscope. Les mesures géochimiques consistent en des déterminations de sels nutritifs et de CO2 total et alcalinité, qui sont sujets à changements du fait de l'activité biologique. Des mesures d'optique ont aussi eu lieu (réflectance de la surface de l'océan, absorption de lumière par les particules et par la matière organique dissoute) de façon à construire une base de données qui sera utilisée pour rechercher les relations entre les propriétés de l'océan et la couleur de l'océan détectée par satellite.
Les protocoles et procédures d'analyse utilisés pour produire les données GeP&CO sont décrits ci-dessous. L'une des méthodes qui vise à mesurer la concentration en phycoérythrine est en cours de développement et est brièvement décrite : elle utilise des spectres d'excitation-émission de fluorescence par des volumes d'eau de mer concentrés sur une membrane filtrante.
II.- Conditions d'échantillonnage en mer
Un local sur le pont principal a généreusement été mis à la disposition du projet GeP&CO, pour les tâches de filtration d'eau de mer, conditionnement des prélèvements et stockage, ainsi que pour les mesures au spectrophotomètre de spectres d'absorption de lumière par la matière organique colorée dissoute. Des prélèvements d'eau de mer ont lieu toutes les 4 heures (soit en heure locale à 6h00, 10h00, 14h00, 18h00, et 22h00 ; il n'y a pas de prélèvement à 2h00) dans la salle des machines, à l'entrée du circuit de refroidissement, à environ 5 m de profondeur, où un thermosalinographe a été installé (Delcroix et al., 1998). La durée du trajet est d'environ 38 jours. Ensuite, il faut de nouveau 38 jours avant que le navire revienne en escale au Havre, puis une semaine à deux mois avant que les mesures soient faites. Ainsi, le stockage des prélèvements varie en général de 50 à 140 jours. Tous les prélèvements (à l'exception des flacons pour l'analyse du CO2 total et de l'alcalinité) sont stockés à -80°C, de façon à empêcher la dégradation des propriétés biologiques et optiques (Sosik, 1999).
III.- Mesures de la concentration en sels nutritifs
Des prélèvements d'eau de mer ( 20 ml, dans des tubes en polyéthylène, empoisonnés avec du chlorure mercurique et conservés à -80°C jusqu'à l'analyse) sont traités sur un analyseur Technicon AAII à 4 canaux.
Les phosphates réagissent avec du molybdate d'ammonium et de l'oxytartrate d'antimoine pour former un complexe phosphomolybdique jaune. Celui-ci est ensuite reduit par de l'acide ascorbique pour obtenir une coloration bleue qui est proportionnelle à la concentration en phosphate.
La détermination of nitrite se fait aussi par colorimétrie, basée sur le composé rouge qu'il donne avec le sulfanilamide et l'ethylènediamine naphtyl. La concentration en nitrate est la différence entre nitrate + nitrite (après que le nitrate ait été réduit en nitrite par du chlorure d'ammonium en présence de cadmium cupérisé) et nitrite seul.
Les silicates (pour l'essentiel, de l'acide orthosilicique) réagit avec du molybdate d'ammonium pour donner un complexe silicomolybdique jaune. Le phosphate en est retiré au moyen d'acide oxalique. Finalement, après réduction à laide de métol (??), une coloration bleue se développe que l'on utilise pour estimer la concentration en silicate.
Les concentrations finales (µg/l) sont obtenues par comparaison avec des standards de NO2, NO3, PO4 et Si(OH)4 traités de la même façon.
IV.- Mesure de CO2 total et d'alcalinité
L'eau de mer est prélevée directement dans des flacons en verre de 0,5 L dans lesquels elle est conservée jusqu'à l'analyse au laboratoire. On laissedéborder l'eau de mer pendant une minute environ, en évitant les bulles d'air, puis on ajoute 1 ml d'eau saturée de chlorure mercurique pour la conservation. Le flacon est ensuite bouché avec un bouchon en verre rodé enduit de graisse Apiezonâ , en laissant 1 ml d'air à l'intérieur afin d'éviter les conséquences d'une dilatation lors d'augmentations de la température. Ces flacons sont conservés à température ambiante jusqu'au Laboratoire de Biogéochimie et de Chimie Marines (LBCM) oùils sont analysés par addition d'acide et potentiométrie, selon Goyet et al. (1991).
Pour les campagnes GeP&CO_A à _C, la correction en fonction de la salinité a été faite en utilisant les valeurs de salinité enregistrées par le thermosalinographe du Contship London (http://www.ird.nc/ECOP/siteecopfr/cadres.htm"). Pour les autres campagnes, des prélèvements d'eau de mer ont été faits pour des mesures de salinité en même temps que ceux pour le carbonate total et l'alcalinité, et ces mesures sont utilisées pour corriger de l'effet de la salinité.
V.- Mesure des pigments photosynthétiques par HPLC
Des prélèvements d'eau de mer sont filtrés sur filtres Whatman GF/F de 25 mm de diamètre, avec un vide maintenu au dessous de 0,25 atm. La filtration est interrompue et le volume filtré est mesuré au bout d'une heure de filtration, de façon à éviter la dégradation ou la perte de pigments qui pourrait intervenir lorsque les filtres se colmatent et que la filtration se prolonge trop longtemps. Le volume qui est filtré dans ces conditions est ordinairement de 2,5 ou 3 litres dans des eaux pauvres, et seulement 1,5 litre dans des eaux côtières riches. Les filtres sont ensuite pliés en deux avec les cellules du phytoplancton à l'intérieur, insérés dans un sachet en plastique préalablement numéroté, et entreposés à -80°C. Ils sont récupérés à l'escale suivante au Havre, transportés au LODyC à Paris, puis à la Station Marine d'Arcachon à l'aide de conteneurs emplis de neige carbonique.
Les mesures sont faites à Arcachon sur l'équipement pour chromatographie liquide haute performance du Laboratoire d'Océanographie Biologique. Cet équipement, un système HPLC Thermo Separations, possède une pompe binaire, une colonne C8 Licospher de 3 µm de porosité, de dimensions 250 x 4 mm, maintenue à 30°C, et un détecteur à barrette de diode Thermo Separations UV LP 6000. Il est muni d'un automate réfrigéré qui peut tenir plusieurs prélèvements, ce qui permet de lancer une série de mesures chaque nuit.
La méthode de dosage utilisée pour GeP&CO est adaptée de celle de Goericke et Repeta (1993). Les filtres sont extraits dans 2 ml de méthanol à 100% pendant une heure à 4°C à l'obscurité après passage aux ultrasons pendant 15 secondes. Les extraits sont passés à travers des filtres à 0.2µ afin d'enlever toutes les particules solides, puis placés dans le passeur automatique qui est capable de refroidir les extraits de pigments à 2°C et de leur ajouter de l'acétate d'ammonium 1 M (2:1, v/v) avant l'injection. Le flux d'éluant pour la séparation des pigments est de 0,6 ml/min. La proportion de solvants varie linéairement pendant la séparation, selon le programme suivant (minute; % solvant A; % solvant B) : (0;75;25), (1;50;50), (20;30;70), 25;0;100), (35;0;100), (40;0;75). Le solvant A est composé de méthanol et d'acétate d'ammonium 1 M dans la proportion 70:30 et le solvant B est du méthanol à 100%. La colonne est alors régénérée aux conditions originales pendant 10 min. Les pigments sont détectés selon leur absorption à 440 nm.
Les chromatogrammes numériques sont enregistrés et traités avec le logiciel PC1000 de Thermo Separations. Des standards de pigments achetés à DHI Water and Environment, à Horsholm au Dannemark servent pour la calibration des mesures.
VI.- Mesures des pigments chlorophylliens par spectrofluorimetrie
Filtration et stockage des filtres sont effectuès de la même manière que ci-dessus pour les mesures par HPLC, la principale différence résidant dans le volume filtré qui est d'un demi litre seulement, ce qui nécessite habituellement moins de 10 minutes et réduit au minimum les dégradations aux cellules. Les mesures sont réalisées au LODyC à Paris, sur un spectrofluorimètre Hitachi F-4500. Les filtres sont d'abord broyés avec la pointe d'une baguette de verre fraîchement cassée dans 6 ml d'acetone à 90% dans des tubes de verre de 10 ml. Les tubes sont alors bouchés et entreposés pour l'extraction toute une nuit à l'obscurité dans un réfrigérateur. Après l'extraction, le contenu de chaque tube est centrifugé, un ml est transféré dans une cuvette de quartz de 1 cm x 1 cm, et les spectres d'excitation-émission de fluorescence sont mesurés dans le spectrofluorimètre, qui opère en mode ratio. Le protocole de mesure est le suivant : la longueur d'onde d'excitation varie de 390 à 480 nm, par pas de 3 nm, et la fente d'excitation est ajustée à 5 nm, et l'émission est mesurée de 620 à 720 nm par pas de 4 nm step, avec la fente d'émission ajustée à 10 nm. On recueille ainsi 31 x 26 = 806 mesures de fluorescence pour chaque prélèvement.
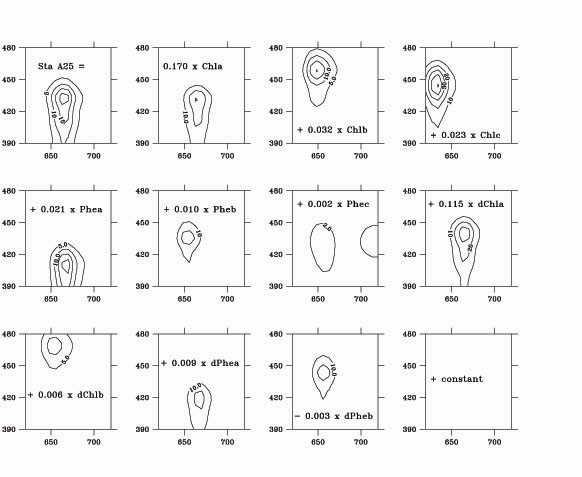
Le calcul des concentrations en pigments chlorophylliens est ensuite effectué selon la méthode de Neveux et Lantoine (1993), qui repose sur le principe que chacune de ces 806 valeurs de fluorescence est la somme des contributions de n pigments distincts, de concentrations C1, C2…Cn. Les Cis sont alors estimés comme étant les valeurs qui minimisent :
(1)
où F est la fluorescence du prélèvement aux longueurs d'onde l exc et l em, et
est la fluorescence aux mêmes longueurs d'onde du pigment i avec une concentration égale à l'unité, déterminée sur des pigments purs lors de la calibration de l'instrument (figure 1). La principale amélioration par rapport à la méthode initialement decrite par Neveux et Lantoine (1993) vient du nombre de mesures de fluorescence qui est ici égal à 806 au lieu de 24, ce qui permet une meilleure discrimination des pigments dont les propriétés de fluorescence ne diffèrent que faiblement.
Nous utilisons actuellement n = 13 pigments : chlorophylle a, chlorophylle b, chlorophylle c2 , chlorophylle c3, pheophytine a, pheophytine b, pheophytine c2, pheophytine c3, divinyl-chlorophylle a, divinyl-chlorophylle b, divinyl-pheophytine a, divinyl-pheophytine b, et un pigment fictif avec un spectre d'excitation-émission de fluorescence uniforme qui rend compte du bruit de fond et de la turbidité de l' extrait. Les concentrations sont présentées dans cet ordre dans les tableaux de résultats auxquels on peut accèder sur ce site web; la concentration du pigment fictif n'est pas donnée. On peut ajouter de nouveaux pigments à l'analyse numérique, dès lors que des standards deviennent disponibles. Minimiser Q2 numériquement donne parfois des concentrations légèrement négatives pour quelques pigments dont la concentration est très faible. Dans de tels cas, le calcul est refait sans ces pigments, jusqu'àce qu'on ne trouve plus que des concentrations positives. Les concentrations sont en milligrammes par mètre cube.
Figure 1 : principe numérique de la détermination des chlorophylles par spectrofluorimétrie.
Ces mesures sont calibrées avec des pigments standards achetés à DHI Water and Environment, à Horsholm, au Dannemark. La divinyl chlorophylle b a été préparée, isolée et quantifiée par Jacques Neveux. L'évolution de la calibration pendant l'expérience GeP&CO est montrée et discutée dans derivefluo.pdf
VII.- Mesure de la phycoérythrine par spectrofluorimétrie
Dandonneau, Yves, et Niang, A. (2007), Assemblages of phytoplankton pigments along a shipping line through the North Atlantic and tropical Pacific. Progress in Oceanography, 73 (2): 127-144.
(updated on 2008 nov 25)
VIII.- Comptages de picoplancton par cytométrie en flux
Des prélèvements d'eau de mer de 1,5 ml sont placés dans des cryotubes et empoisonnés avec du glutaraldéhyde à 1‰, puis stockés à -80°C jusqu'à l'analyse au laboratoire. Les mesures de cytométrie en flux sont réalisées dans les deux heures qui suivent la décongélation sur des volumes d'eau de 0,1 ml, en utilisant un cytomètre en flux Becton-Dickinson équipé d'une système de fluorescence FACScan. Les comptages de bactéries sont faits séparément sur un autre volume d'eau traité avec du Syber green. Le liquide d'entraînement est constitué d'eau de mer filtrée, et la calibration utilise des billes de 2µ (Blanchot et Rodier, 1996). Le traitement des données brutes est fait avec le logiciel LYSYS II de Becton-Dickinson, et l'analyse finale pour l'identification et le dénombrement de Prochlorococcus spp., Synechococcus spp., des picoeucaryotes et des bactéries utilise le logiciel cytowin (Vaulot, 1989).
IX.- Comptages de Coccolithophoridés
Les filtrations d'eau de mer (1,5 L) ont lieu à bord sur des filtres Millipore en nitrocellulose de type AA, de 25 mm de diamètre. Les filtres sont ensuite rangés dans des boites à biopsie et conservés au sec jusqu'à identification et comptage des cellules de Coccolithophoridés à l'aide d'un microscope, avec un grossissement de 1250 (Eynaud et al., 1999).
X.- Absorption de lumière par les algues
Les prélèvements d'eau de mer sont filtrés à bord (filtres Whatman GF/F de 25 mm de diamètre, volume approximatif 2 L) puis stockés à -80°C dans des boites à biopsie jusqu'à l'analyse au laboratoire. Les spectres d'absorption de lumière par les algues sont mesurés avec un spectrophotomètre Beckman DU 640, en plaçant le filtre dans l'instrument à proximité immédiate de la fenètre du photorécepteur, conformément à Dupouy et al. (1997). La mesure se fait en deux temps : d'abord, l'absorption de lumière par le filtre est mesurée de 400 à 800 nm (par pas de 1 nm), puis les pigments photosynthétiques sont extraits à l'aide de méthanol chaud (Kishino, 1985), le filtre est placé de nouveau dans le spectrophotomètre, dans la même position, et l'absorption est mesurée de nouveau. L'absorption de lumière par les algues est la différence entre les deux mesures. En principe, la mesure après extraction des pigments au méthanol représente l'absorption par les particules. Cependant, les filtres collectés lors des campagnes GeP&CO portaient une coloration résiduelle rouge probablement causée par la peinture antifouling du navire, et cette dernière mesure n'est pas incluse dans la base de données GeP&CO.
XI.- Absorption de lumière par la matière organique colorée dissoute (CDOM)
La méthode de mesure est adaptée de celle de Mitchell et al. (2002). Les prélèvements d'eau de mer (volume approximatif : 100 ml) sont filtrés sur filtres Nuclepore, de 25 mm de diamètre, et de 0.1 micron de porosité. Les 2 ou 3 premiers ml sont utilisés pour rincer le filtre et sont éliminés. L'eau filtrée restante est gardée dans des flacons en verre brun à température ambiante à l'obscurité. Ce stockage dure au maximum 16 h, de 6:00 am à 10:00 pm. Les prélèvements réalisés un jour donné sont tous mesurés à la fin de ce même jour. Les spectres d'absorption de lumière sont mesurés de 200 à 800 nm dans une cuvette de 10 cm de trajet optique, dans un spectrophotomètre Beckman DU 640. Une ligne de base obtenue avec de l'eau Milli-Q est soustraite. La qualité de cette eau de référence est vérifiée par rapport à l'absorption par l'air.
Références
Blanchot, J. and M. Rodier 1996. picophytoplankton abundance and biomass in the western tropical Pacific Ocean during the 1992 El Niño year : results from flow cytometry. Deep-Sea Research I 43: 877-895.
Delcroix, T., L. Gourdeau, and C. Hénin 1998. Sea surface salinity changes along the Fiji-Japan shipping track during the 1996 La Niña and 1997 El Niño period. Geophysical Research Letters 25: 3169-3172.
Dupouy, C., J. Neveux, and J.M. André 1997. Spectral absorption coefficient of photosynthetically active pigments in the equatorial Pacific Ocean (165°E-150°W). Deep Sea Research II 44: 1881-1906.
Eynaud, F., J. Giraudeau, J.-J. Pichon, and C.J. Pudsey 1999. Sea-surface distributions of coccolithophores, diatoms, silicoflagellates and dinoflagellates in the South Atlantic Ocean during the late austral summer 1995. Deep-Sea Research I 46: 451-482.
Goericke, R. and D.J. Repeta 1993. Chlorophylls a and b and divinyl chlorophylls a and b in the open subtropical North Atlantic Ocean. Marine Ecology Progress Series 101: 307-313.
Goyet, C., C. Beauverger, C. Brunet, and A. Poisson 1991. Distribution of carbon dioxide partial pressure in surface waters of the southwest Indian Ocean. Tellus 43B: 1-11.
Kishino, M., M. Takahashi, N. Okami, and S. Ichimura 1985. Estimation of the spectral absorption coefficients of phytoplankton in the sea. Bulletin of Marine Science 37: 634-642.
Lantoine, F. and J. Neveux 1997. Spatial and seasonal variations in abundance and spectral characteristics of phycoerythrins in the tropical Northeastern Atlantic ocean. Deep-Sea research I 44: 223-246.
Mitchell, B.G., M. Kahru, J. Wieland, and M. Stramska 2002. Determination of spectral absorption coefficients of particles, dissolved material and phytoplankton for discrete water samples. NASA/TM-2002-210004/Rev3 2: 231-257.
Neveux, J. and F. Lantoine 1993. spectrofluorometric assay of chlorophylls and phaeopigments using the least squares approximation technique. Deep-Sea Research 40: 1747-1765.
Sosik, H.M. 1999. Storage of marine particulate samples for light-absorption measurements. Limnology and Oceanography 44: 1139-1141.
Vaulot, D. 1989. CYTOPC : processing software for flow cytometric data. Signal Noise 2: 8.
Vodacek, A., N.V. Blough, M.D. DeGrandpre, E.T. Peltzer, and R.K. Nelson 1997. Seasonal variation of CDOM and DOC in the Middle Atlantic Bight : Terrestrial inputs and photooxidation. Limnology and Oceanography 42: 674-686.