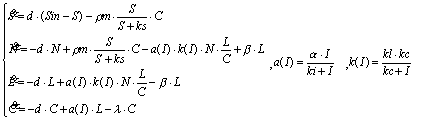click to go to .... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| II.1. COMPETENCE DES EQUIPES PARTICIPANTES II.1.1. Etudes expérimentales en milieu contrôlé (LOV) II.1.2. Photoadaptation et outils de la biologie moléculaire (AVCR) II.1.3. Modèles de processus – Techniques de validation – Outils de l'Automatique (INRIA) II.1.4. Modèles hydrodynamiques – Couplage physique - biologie (LODYC) II.2. ACTIONS PROGRAMMEES II.2.1. Etude expérimentale de la photoadaptation au niveau moléculaire II.2.2. Modélisation du rapport q sur la base d'expériences en milieu contrôlé II.2.3. Elaboration de techniques de validation qualitative des systèmes dynamiques II.2.4. Utiliser la connaissances des propriétés hydrodynamiques pour expérimenter II.2.5. Couplage d'un modèle de photoadaptation avec un modèle physique II.2.6. Rappel des opérations et calendrier prévisionnel |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le projet, dont la durée de vie minimale est estimée à 4ans, s'appuie sur les expertises différentes de quatre laboratoires: · LOV (Laboratoire d'Océanographie de Villefranche-sur-mer)
·
AVCR, Laboratory of
Photosynthesis, Institute of Microbiology, Trebon, Rep. Tchèque · INRIA (Institut National de Recherche en Informatique et Automatique, Projet COMORE: Contrôle et Modélisation des Ressources Renouvelables) · LODYC (Laboratoire d'Océanographie Dynamique et de Climatologie) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
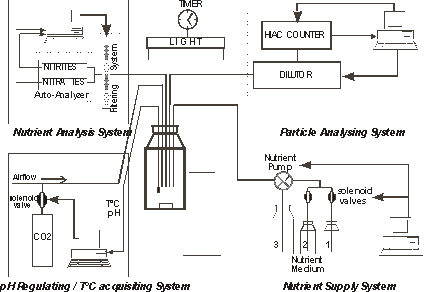
L'automate de culture développé au LOV (Laboratoire Océanologique de Villefranche) a été spécifiquement conçu pour l'étude expérimentale des processus d'adaptation (Bernard et al. 1996; Collos et al. 1998; Le Floc'h et al. in revision; Malara et Sciandra 1991; Sciandra 1991; Sciandra et Amara 1994; Sciandra et al. 1997; Sciandra et al. 2000; Sciandra et Ramani 1994; Stramski et al. 2002) . Il permet de réguler en entrée la forme et l'amplitude de variation des paramètres qui contrôlent la croissance autotrophe (flux de photons, de nutrilites, température, pCO2), et de mesurer automatiquement en sortie les principales variables du système (taille et concentration des cellules, nutriment (nitrate et nitrite), spectre d'absorption, pH). Il s'agit de systèmes ouverts (chémostats, turbidostats), pouvant donc être échantillonnés abondamment et semi-continuellement pour l'estimation de quota divers ou d'activités enzymatiques, et ce, sur de longues périodes. Il se prête donc particulièrement bien au suivi des phénomènes transitoires. Au cours des 10 dernières années, ce système a suscité l'organisation d'ateliers de travail réunissant la compétence de chercheurs sur des aspects variés de la croissance de diverses espèces autotrophes (chlorophycées, diatomées, dinoflagellés, procaryotes, coccolithoporidés, rhodophycées). Dans sa configuration actuelle, les modules qui assurent l'automatisme et le contrôle des différentes tâches sont indépendants. Un travail important est actuellement conduit en collaboration avec l'INRIA pour doter ce système d'un environnement informatique et automatique performant, permettant d'accroître ses fonctionnalités, notamment par le biais d'un contrôle centralisé des différents modules grâce à l'implantation d'un serveur intelligent.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le laboratoire de Photosynthèse de l'Institut de Microbiologie de Trebon (République Tchèque) étudie les bases moléculaires des relations structurelles et fonctionnelles du Photosystème II, et sa régulation en réponse à des perturbations biotiques ou abiotiques. Ces études s'appliquent: · aux mécanismes de régulation photosynthétique chez les algues et chez les cyanobactéries cultivées en photo-bioréacteurs de laboratoire ou in situ en conditions naturelles (phytoplancton d'eau douce ou marin), · aux mécanismes moléculaires d'inactivation du Photosystème II, photo-inactivation et sur-oxidation. Ces projets font l'objet d'une recherche fondamentale financée par des organismes Tchèques et Internationaux (NATO, EU, NSF, plusieurs collaborations bilatérales), mais également d'une recherche appliquée à l'environnement et à l'agriculture. Le laboratoire est bien équipé pour cultiver des algues en milieu contrôlé de lumière et de température, et procéder à des études sur la photosynthèse algale par le biais de méthodes biophysiques, biochimiques et de la biologie moléculaire. L'équipe est partenaire du Centre National de la Recherche sur les Mécanismes, l'Ecophysiologie et la Biotechnologie de la Photosynthèse, qui réunit les laboratoires leader dans ce domaine en République Tchèque. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
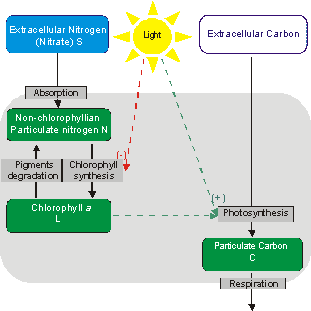
Schematic representation of the photoadaptation model developed at Villefranche (Equations are below). This model has 3 phytoplankton variables (green boxes), and one for the limiting nutrient (blue box). The main hypothesis is that light limitation can stimulate new chlorophyll synthesis, only if the nitrogen status of the cell allows the creation of the apoproteins built-in with the pigment complexes. This simple structure allows to simulate a deregulation of photoadaptation in case of nitrogen limitation (From Pawlowski et al. 2002) Une méthode systématique de modélisation des systèmes biologiques, fondée sur la conservation de la masse, est en cours de développement au sein de l'équipe COMORE. Elle repose sur la détermination d'un ensemble de relations linéaires traduisant la conservation de la masse, indépendamment des cinétiques des sous-processus du système. Cette manière de représenter les systèmes biologiques permet notamment de structurer un modèle et d'en hiérarchiser les hypothèses. Elle propose des outils pour valider les différents niveaux du modèle (répartition des flux de matière entre les différentes composantes du système, modélisation de ces flux, etc.). Cette démarche a notamment été utilisée pour écrire un premier modèle de croissance phytoplanctonique (Pawlowski et al. 2002) rendant compte du couplage entre les deux voies métaboliques du carbone et de l'azote. Cette démarche de modélisation est complétée par une approche de validation, élaborée par l'équipe, qui permet de caractériser la capacité structurelle d'un modèle (c'est à dire indépendamment de ses paramètres et des fonctions mathématiques utilisées) à reproduire les caractéristiques qualitatives du comportement transitoire observé expérimentalement. La méthode d'analyse dynamique qualitative vérifie que les interactions entre variables, telles qu'elles figurent dans la matrice jacobienne, sont compatibles avec la série des extrema (ou des passages par des valeurs de référence) des mesures au cours du temps. Cette approche, appliquée aux modèles de croissance à quota interne de type Droop, a permis d'en cerner les domaines de validité (Bernard 1995; Bernard et Gouzé 1995; Bernard et Gouzé 1996, Bernard et Gouzé 2002) .
Les outils précédents ont permis d'élaborer un modèle de dimension 4 (Eveillard, 2000) , Pawlowski 2001) , qui représente la dynamique du carbone, de l'azote et de la chlorophylle particulaires, ainsi que des nitrates. L'hypothèse centrale qui différencie ce modèle des structures proposées par Geider et al. (1998) et Flynn et al. (2001) , repose sur un fractionnement de l'azote cellulaire entre un pool dévolu à la synthèse pigmentaire dont le taux est régulé par le flux de photons, et un pool utilisé pour le reste du métabolisme, la répartition entre les deux étant une fonction de la demande en pigments et de la disponibilité en azote inorganique dissous. Une validation qualitative du système d'équations différentielles a déjà été obtenue (Pawlowski et al. 2002) sur la base de données acquises à l'état stationnaire (Le Floc'h et Sciandra 2000) . Ce modèle, qu'il faut améliorer et valider en conditions dynamiques, sera le point de départ de l'étude. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L' équipe "Études des cycles biogéochimiques et des écosystèmes marins à l'aide de la modélisation numérique" du LODYC étudie le fonctionnement des cycles géochimiques et de l'activité biologique dans l'océan. Le développement et la validation de modèles biogéochimiques sont des préalables indispensables. L’équipe a mis au point différents modèles biologiques de complexité variable. Ces modèles sont utilisés conjointement au modèle d'océan aux équations primitives OPA, ce qui permet d'aborder la variabilité des cycles biogéochimiques en liaison avec la variabilité de la circulation océanique, sur une gamme d' échelles spatiales allant de la sub-mésoéchelle à l'échelle globale, et d'échelles temporelles allant de la journée à la dizaine d'années. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'organisation
du plan de travail à venir doit tenir compte d'actions
actuellement en cours et d'opérations déjà programmées sur le court
terme. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Des expériences seront menées à Villefranche-sur-mer en collaboration avec l'Institut de Microbiologie de Trebon. Leur objectif sera d'obtenir des informations sur la physiologie de la photoadaptation chez des cellules soumises à des interactions croisées de flux de photons et de nutrilites. Des conditions expérimentales permettant de reproduire un forçage physique contraignant les cellules dans une couche soit riche, soit dépourvue de nutriments, ont déjà été imaginées, bien que celles-ci devront être revues à la suite de rencontres organisées avec les physiciens du LODYC. Les
variables qui seront mesurées périodiquement seront: (1) les nutriments
et le carbone inorganique, (2) le flux de photons et sa composition
spectrale, (3) la densité et la distribution en taille des cellules,
(4) les quota internes de carbone et d'azote, (5) la chlorophylle a et
les pigments accessoires, (6) les spectres d'absorption cellulaire,
(7) les courbes P vs. I. En plus de ces mesures discrètes, seront enregistrés
en continu: (8) le flux de photons incident, le coefficient d'atténuation
lumineux et le taux de dilution, de sorte que le taux de croissance
sera connu à tout moment, et enfin, (10) la fluorescence de la chlorophylle à l'aide
du fluorimètre PAM pour enregistrer la réponse instantanée de l'appareil
photosynthétique à la lumière. Sur des intervalles de temps choisis,
des échantillons supplémentaires serviront à examiner: (11) les réponses
au stress de la photo-oxidation, (12) les pools dissous d'acides aminés
et de glycolate, et (13) les protéines associées aux complexes pigmentaires
ou d'autres protéines photosynthétiques (D1, Rubisco), ainsi que les
ARNm qui codent pour ces protéines, afin d'identifier les contrôles
existant aux niveaux transcription et traduction de leur biosynthèse. Les espèces potentielles pour ces expériences sont Phaeocystis, Thalassiosira, Pelagomonas et Synechococcus. Phaeocystis et Thalassiosira sont fréquentes dans les communautés associées aux blooms printaniers des eaux Nord Européennes. Ces espèces sont des modèles de laboratoire appropriés parce que la nature du régime lumineux est actuellement considérée comme étant le facteur majeur déterminant l'issue de la compétition entre Phaeocystis et les diatomées en eaux côtières (Peperzak et al. 1998). Pelagomonas et Synechococcus sont des représentants eucaryote et procaryote importants des communautés phytoplanctoniques oligotrophes rencontrées dans les régions sub-tropicales de l'océan Nord-Atlantique. Ces espèces sont également intéressantes dans le cadre de ce projet car la capacité à effectuer des réserves azotées en régime lumineux fluctuant est vraisemblablement un élément déterminant pour leur survie au sein de ces tourbillons. Idéalement, ces quatre espèces devraient être étudiées pour des conditions nutritives limitantes et non limitantes. Cependant le choix dépendra des possibilités matérielles offertes en temps réel. Un protocole provisoire peut néanmoins être proposé, qui prend en compte les combinaisons espèces/conditions de laboratoire correspondant le mieux aux situations naturelles.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cette action constitue le corps de la thèse que Lionel Pawlowski a entamée au LOV en septembre 2001 sous la direction d'Antoine Sciandra et d'Olivier Bernard, et qui se décompose en trois volets: · Amélioration des fonctionnalités techniques du système automatique de culture de Villefranche-sur-mer. Ce travail, effectué en collaboration avec l'INRIA (affectation d'un ingénieur CDD au LOV en 2002 et 2003), a deux objectifs: - Rajouter des modules de mesure en ligne d' O2 et de CO2 en entrée et en sortie des cultures continues, de façon à connaître en temps réel les termes de la production. Ces données seront très utiles sur le plan biologique (calibration des méthodes parallèles de production: incorporation de marqueurs au 14C), et sur le plan de la modélisation (fermeture des bilans de matière, voir II.1.3). - Unifier la structure informatique du système par l'implantation d'un serveur accessible à distance. A terme, ce système centralisé doit permettre de programmer les actions à effectuées sur les cultures en fonction de critères mesurés en temps réel, autrement-dit d'asservir les entrées aux sorties. Cela permettra, à terme, de perturber la physiologie des algues en fonction de leur état. · Conduites d'expériences en milieux variables de flux de photons et de nitrate. Une partie de ces expériences sera conduite en collaboration avec l'Institut de Microbiologie de Trebon (voir l'action précédente), une autre après définition de protocoles expérimentaux établis en collaboration avec le LODYC. Pour le moment, les espèces ne sont pas définitivement choisies, mais devront répondre à des compositions spécifiques typiques identifiées lors des différentes phases de POMME. L'unité expérimentale de base sera le chémostat, le facteur limitant très probablement l'azote inorganique dissous (NO3). Une réflexion est actuellement menée sur l'opportunité d'utiliser des chémostats interconnectés entre eux pour simuler des gradients nutritifs. Le mode de limitation temporel sera assuré par un automate. La régulation du flux de photon s'inspirera du système développé par Marcel Babin (Bruyant et al. 2001) , adapté pour la circonstance. Les paramètres mesurés seront l'absorption spectrale des cellules, leur concentration et leur spectre de taille, la composition pigmentaire (HPLC), les nitrate et nitrite résiduel, la pCO2, le pH, l'alcalinité, etc. · Modélisation du rapport q mesuré au cours des expériences. Le travail portera sur l'amélioration du modèle existant en fonction des données expérimentales produites, ainsi que sur l'étude de son comportement en régime dynamique. Cette réflexion permettra notamment d'identifier les modifications qu'il sera nécessaire d'apporter à son écriture pour que les transitoires expérimentalement observés soient reproduits, tout en veillant à préserver sa faible dimension. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cette action sera dans la continuité d'une collaboration entretenue avec l'INRIA dans le cadre du projet commun INRIA/CNRS COMORE. Un des aspects de ce programme a trait à la modélisation des systèmes biologiques. Les techniques de validation qualitative originales développées au sein de cette équipe (voir II.1.3.) trouveront un champ d'application unique dans les expériences menées à Villefranche. D'autre part, l'expertise que cette équipe possède sur la théorie mathématique des systèmes dynamiques en général, et sur leur modélisation en particulier, sera mise à profit pour faire progresser une réflexion concernant le couplage de modèles, les transferts d'information en échelles fonctionnelles, le choix entre classes de modèles, le déterminisme des réseaux trophiques, leur niveau de représentation phénoménologique optimale, l'équilibre entre observations et représentation, autant de questions théoriques dont les réponses seront mieux exprimées dans le contexte d'une collaboration entre mathématiciens et biologistes. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cette action est à mener en amont et parallèlement à toutes les autres, et devra bénéficier de leurs retombées. Deux aspects essentiels seront abordés en relation avec les problématiques biogéochimiques et de modélisation qui se posent dans le cadre du programme POMME. Le premier concerne l'influence des régimes hydrodynamiques sur les processus de photoadaptation, le second, la différentiation spécifique associée à ces régimes. Ces deux aspects (fonction et diversité) sont interdépendants, et peuvent bénéficier d'une approche expérimentale dont le protocole doit être clairement établi à l'avance en concertation avec les modélisateurs. L'état actuel de nos connaissances sur le système POMME nous permet d'identifier, encore approximativement pour le moment, 3 situations types qu'il conviendrait de reproduire au laboratoire, au moins dans l'action II.2.2. Chacune de ces situations est caractérisée sur le long terme (quelques semaines) par des états moyens, lesquels états sont perturbés à court terme (1 à quelques jours) par le forçage hydrodynamique. La production primaire et la photoadaptation doivent être étudiées dans chacun de ces contextes, en prenant en compte les effets transitoires associés aux perturbations, et les relations qui existent entre les espèces (groupes fonctionnels) impliquées et la nature des situations types identifiées. · Régime hivernal (POMME 1). L'état moyen est caractérisé par une couche de mélange plus profonde que la couche euphotique, des sels nutritifs abondants. Les cellules passent en moyenne plus de temps dans des zones de faible intensité lumineuse. Les perturbations peuvent être associées à une stratification momentanée résultant de l'activité mésoéchelle ou de conditions atmosphériques favorables: pendant une courte période, le flux de photons intégré sur la journée va être accru, entraînant un épuisement plus rapide des sels nutritifs. · Régime de bloom/post bloom (POMME 2). Dans ce régime, l'état moyen est en fait une situation de transition continue caractérisée par un état de limitation augmentant dans le temps en conséquence de l'épuisement progressif des sels nutritifs. La couche de mélange est, par opposition avec le régime hivernal, moins importante que la couche euphotique, et les cellules bénéficient de ce fait d'un éclairement substantiel pendant toute la phase claire du cycle lumineux. On peut s'attendre à ce que les perturbations, dont l'origine peut être des coups de vent provoquant la subduction des cellules hors de la couche euphotique par mélange vertical, soient néfastes pour les cellules, bien que celles-ci, bénéficiant en retour d'un excès de nutriment, puissent mettre en place les processus de photoadaptation nécessaires à leur survie. L'effet d'une telle perturbation va finalement conduire les cellules à explorer transitoirement un milieu proche de celui qui caractérise le régime hivernal. · Régime oligotrophe (POMME 3). Ce qui caractérise l'état moyen de ce régime est un maximum de chlorophylle en sub-surface, une stratification forte et une co-limitation importante par les nutrilites et la lumière. En conséquence, les perturbations trouveront leur origine dans des processus d'advection verticale, dont la durée sera déterminante dans le succès des espèces à exploiter les nouvelles conditions de croissance qui leur seront imposées. Dans un premier temps, la collaboration avec les chercheurs du LODYC devra donc permettre de définir les conditions expérimentales qui permettront de reproduire au mieux les différents régimes décrits ci-dessus, en terme de nutrilites, d'éclairement et de température. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Une fois qu'un modèle de photoadaptation aura été validé sur des expériences ad hoc, il sera couplé avec une structure physique reproduisant les propriétés hydrodynamiques ayant servi à concevoir les expériences de laboratoire. Une étude des propriétés de l'ensemble sera conduite en recherchant à définir les critères de faisabilité et d'utilité décrit dans le chapitre I.4.4. Un cadre de départ existe pour cette étude. Nous disposons d’un modèle 1D de production (Zakardjian et Prieur, 1998), qui permet de simuler le déplacement des cellules photosynthétiques dans le champ de lumière, lorsque ces déplacements sont courts par rapport au temps de doublement. Ce modèle, en physique stationnaire, mais avec biologie et chimie évolutive, est fondé également sur une limitation alternative, photons, sels nutritifs. Il est étendu actuellement à deux groupes de phytoplancton et deux groupes de zooplancton avec formation de matériel détritique aux fins de comparaison avec les données de stock et de production obtenues lors des campagnes Almofront et Pomme. Par ailleurs le code 3D de ce modèle est également disponible et tourne en s’appuyant sur les champs dynamiques issus de modèles 3D de dynamique. On cherchera à implanter dans ce type de modèle les effets possibles de la convection sur la production primaire lorsque la couche de mélange est plus épaisse que la couche euphotique, situation fréquemment rencontrée en hiver, alors que les observations font état d’une production non négligeable. De même on cherchera des paramétrisations pour l’assimilation en compétition de différents sel nutritifs selon des groupes phytoplanctoniques qui tiennent comptent de la taille des cellules et des propriétés environnementales. Dans la mesure du possible ces paramétrisations qui a priori joueront sur les constantes de Michaelis-Menten seront testées en milieu chémostat. Ces paramétrisations seront également confrontées au travers des résultats aux schémas d’assimilation développés par le groupe COMORE. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Les opérations précédemment définies sont: 1. Etude expérimentale de la photoadaptation au niveau moléculaire 2. Modélisation du rapport q sur la base d'expériences en milieu contrôlé 3. Elaboration de techniques de validation qualitative des systèmes dynamiques 4. Définition des protocoles expérimentaux pertinents 5. Couplage d'un modèle de photoadaptation avec un modèle physique
Le tableau ci-dessous donne le calendrier des opérations avec les degrés d'implication de chaque équipe : + : équipe responsable de l'opération où très impliquée + : équipe participant à l'opération ou faiblement impliquée
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||