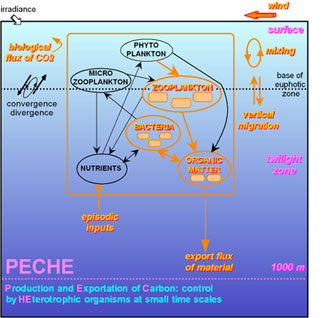
Production and Exportation of Carbon : control by HEterotrophic organisms at small time scales
Valérie
ANDERSEN |
Madelein GOUTX |
The
aim of this project is then to examine short-term temporal variability
of
the primary
production and export
fluxes to depth. It is focussed on the study of the control by heterotrophic
organisms (from bacteria to macrozooplankton) and of the response
of the system to episodic events during a seasonal transition period,
along the vertical dimension. This
project is essentially based on in
situ observations which will be carried out in different seasons:
two cruises, in April (period of abundant zooplankton biomass) and
July (period of minimum downward flux), and a one month time-series
in autumn (September-October). This project also includes some modelling
studies (1-D coupled physical-biological models). The
specific objectives of the three observation periods are: (1) Characterisation of the relative impact
of zooplankton and bacteria (and their associated ecto-enzymes) in
the mineralization of the organic matter, (2) Quantification of the variability
of mineralisation with the
structure of the heterotrophic web and the depth, (3) Estimation of the response of the
ecosystem to transient episodes, such as wind events, at small time
scales of a few hours to a few days during the seasonal transition
from summer to autumn; this aspect will be studied during a multidisciplinary
cruise which will integrate the process studies performed at the other
seasons. Our
overall goal is to improve
the budget of carbon production and exportation throughout the water
column (from the surface to 1000 m depth) and to determine the relative
contribution of the different heterotrophic processes and of the physical
forcings at small time scales. This project will also provide a multidisciplinary data set which will be used to parameterize, constrain and validate a variety of physical-biological models |
Le projet PECHE vise à une meilleure appréciation du contrôle de la production primaire et du flux exporté en profondeur. Il est axé sur l’étude du contrôle par les organismes hétérotrophes (de la bactérie au macrozooplancton) et des réponses du système aux perturbations impulsionnelles. Ce projet est basé principalement sur des observations in situ, mais fait aussi appel à des
travaux de modélisation 1-D couplée physique-biologie. A partir de ce bilan des
connaissances sur le contrôle des flux de matière par les organismes
hétérotrophes et le rôle de la petite échelle temporelle, les principaux
objectifs visés par le projet PECHE peuvent être exprimés de la façon suivante
: - Quel est le rôle du broutage et de
l'excrétion du zooplancton dans le contrôle de la production primaire et dans
la mise à disposition de ressources organiques pour le compartiment bactérien
? - Comment
la diversité structurelle et fonctionnelle du réseau hétérotrophe
influence-t’elle le flux exporté en profondeur ? - Quelle
est la réponse de l'écosystème à l'impact de perturbations impulsionnelles telles
que les coups de vent, réponse non seulement à l'échelle de quelques heures à
quelques jours mais aussi pendant la transition saisonnière ? L'objectif final est d'améliorer le bilan de la production et de l'exportation de carbone sur la colonne d'eau de la surface jusqu'en profondeur (1000 m), et de déterminer la part respective des différents processus hétérotrophes et des forçages physiques à petite échelle de temps. |
|
|
|
|
|
|
The project PECHE is designed to examine
the natural variability of the structure and the dynamics of the pelagic
ecosystems at small time scales and in response to transient events.
The project adresses a major question concerning the functioning of
biological systems in the open ocean and the biogeochemical responses
to global change. In
the pelagic ecosystem, bottom-up control of phytoplankton dynamics
has long been considered as the most important factor in regulating
primary production. The Top-down control, that is predation by herbivores
as well as by carnivores and the pivotal role of zooplankton grazing
on phytoplankton composition dynamics has been only recently emphasized.
While it is clear that the functioning of the trophic web depends then
on the equilibrium between bottom-up and top-down controls, the relative
importance of these controls is a matter of debate. Moreover,
the trophic web presents a large structural and functional diversity,
which determines the efficiency of the biological carbon pumping. Schematically,
the trophic web can be divided into two main pathways : (i) the microbial
loop with controls the circulation and retention of matter in the euphotic
zone (e.g. bacterial mineralization of particulate and dissolved organic
matter, predation and excretion of ciliates) and (ii) the 'macrobial'
web which plays a determinant role in the export flux (e.g. production
of large fecal pellets with high sedimentation rates, diel vertical
migration). The microbial loop is commonly recognized as a major pathway in carbon transfer and regulation in biological systems. At its base, bacteria assimilate and re-mineralize detrital and dissolved organic matter. The importance of chemical composition of organic matter on bacterial metabolisms and dynamics is well known. However, organic matter in the ocean is mainly under the form of polymeric substrates and ecto-enzymatic hydrolysis by specific enzymes is a preliminary step to assimilation of most substrates.Thus, relationships between diversity and functionality within bacterial community is a major challenge for studying the impact of bacterial processes on fluxes of matter and energy. Biological structure strongly coupled with physical structures varies over a large range of time and space scales in the ocean. Importance of the processes occurring at small time scales have been progressively emphasized. In fact, the response of the system to transient episodes are often complex and non-linear. Reliable budgets for the long term periods (seasons to years) cannot be calculated if data are lacking on the short-term variances and covariances. Seasonal transition periods, characteristic of temperate areas, appear particularly critical, as they may influence both seasonal and interannual variability. They are themselves controlled by interactive and successive rapid processes, from hours to a few days. |
|
|
|
|
| This study, based on vertical processes,
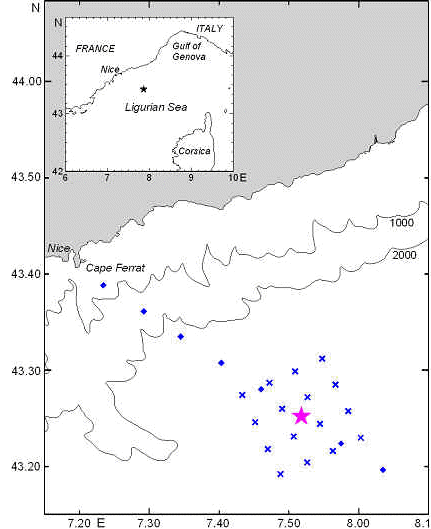
will be conducted in the central zone of the Ligurian Sea (NW Mediterranean)
where advective movements are negligible, in the vicinity of the long-term
time-series station DYFAMED. The multidisciplinary results of this
study, experimental as well as theoretical, could then be extrapolated
to other ocean areas, temperate ones particularly. - Mineralisation of organic matter. Cruises PROPECHE
(April and July 2003) Mineralisation
of organic matter depends on stratification, nutrient conditions and
associated trophic conditions. Zooplankton community outputs can significantly
modify the impact of environmental conditions on the mineralisation
process. Thus, interactions between zooplankton and bacteria will
be specifically examined during
the PROPECHE cruises (PROcess
of organic matter mineralisation within PECHE), using a pluridisciplinary
approach. – Along vertical profiles (0-1000 m),
we will examine the distribution of chemical (nutrients, CHN, DOC,
DON), biochemical (OM composition of proteins, carbohydrates, lipids,
fulvic acids) and microbiological (activities and diversity) parameters
in the dissolved and suspended matter collected during day and night
sampling. - Aggregates will be collected using a
special detritus sampler; fresh faecal pellets will be obtained from
incubation of different sized zooplankton groups sampled with nets. - Chemical, biochemical and microbiological
characteristics of these particles and aggregates will be followed
during short incubation times (< 36 h). - Bacterial biomass, bacterial production,
and bacterial community structure (Finger Printing, CE-SSCP) will be
also examined. - The chemical analysis of biopolymers
will be coupled with the analysis of associated monomers and to the
estimation of hydrolysis rates (using fluorescent analogs and polymeric
substrates). This
approach will be also conducted during the DYNAPROC 2 cruise. Thus,
these observations at three periods characterized by different trophic
organisations would provide insight on zooplankton/bacteria interactions
and basic parameters for mineralization process modelling. - Small time-scales response of the ecosystem to episodic
events during the transition from summer to autumn. Cruise DYNAPROC
2 (September-October 2004)
Wind-induced
mixing events, such as those occurring in autumn in NW Mediterranean,
can increase availability of nitrates in the euphotic layer. What is
the influence of this enhancement on the autumnal bloom of phytoplankton
? On the other hand, microphageous organisms (such as pteropod molluscs
and pyrosomids) occur in large densities at this period and could control
the phytoplankton community which, in autumn, consists mainly of small-sized
cells. Answers
to these questions will be specifically addressed during the cruise
DYNAPROC 2 (DYNAmics of rapid PROCessses in the water column). The
main observations will be done near a fixed station and monitor: daily
variation of phytoplankton biomass and related physical and chemical
parameters, and changes in the trophic web structure and functioning
(e.g. phytoplankton, microbial loop, large filter-feeders). Most of
these biogeochemical studies will be based on measurements at short
time scales (4 to 12 hours) during 48-hours cycles. In
situ observations and sampling will be performed with various technics,
such as CTD and 24-bottle rosette, multiple and opening closing net,
underwater video profiler, moored system for biological fluxes of CO2.
The processes related to primary production will be explored in the
0-200 m water column, those depending on heterotrophic activities from
the surface to 1000 m depth. These process studies will concern: primary
production, physiological rates of zooplankton To
determine the hydrological environment of the fixed station, a grid
of 16 stations, centred on the fixed station, will be occupied at least
four times during the cruise. In
order to document the seasonal transition period and to catch the effects
of the wind event, which can be delayed in the zooplankton response
compared to the phytoplankton response, the cruise will be planned
to last for at least 4 weeks. This cruise will complement the first DYNAPROC cruise (May 1995) which documented the effects of episodic wind events on the transition from the mesotrophic system to an oligotrophic one. A 1-D physical-biological model, first applied to the DYNAPROC data and including vertical advection, will be applied to the time series of DYNAPROC 2 and tested, before to being run at a longer larger time scale. |
|
Les recherches
récentes et les projets en océanographie biologique s’articulent autour
de plusieurs thèmes majeurs dont : (1) les réponses des systèmes biologiques
aux variations globales, en particulier climatiques, et (2) les interactions
entre les cycles biogéochimiques et la structure et le fonctionnement
des écosystèmes. Ce contexte soulève des questions
majeures sur la variabilité naturelle
de la structure et de la dynamique de l’écosystème pélagique, questions
auxquelles notre projet vise à apporter des éléments de réponse. |
|
|
Les images satellitaires
montrent que la physique de l’océan joue un rôle essentiel sur la distribution
spatiale et temporelle de la biomasse phytoplanctonique. Ainsi, les
foyers de production élevée correspondent à des zones d’enrichissement
de la couche euphotique en sels nutritifs. Ce contrôle par les ressources
(bottom-up control des anglo-saxons) a longtemps été considéré comme
déterminant pour la dynamique du phytoplancton, et nettement plus important
que le contrôle par le niveau trophique supérieur ou prédation (top-down
control). L’importance
du contrôle par la prédation, tant des herbivores que des carnivores,
et le rôle pivot du broutage du zooplancton sur la dynamique du phytoplancton
n’ont été soulignés que depuis quelques années, pour l’océan ouvert
en particulier (e.g. Banse, 1994, 1995; Verity & Smetacek, 1996).
L’activité de ces consommateurs secondaires aurait des conséquences
importantes dans la régulation du flux de carbone circulant à travers
le réseau microbien (Christaki & Van Wambeke, 1995). Ainsi le niveau de fermeture (prédation)
dans les modèles de réseau trophique conditionne le comportement de
toutes les variables. Par exemple, Steele & Henderson (1992) ont
rappelé l’importance de la formulation de ce terme au niveau des herbivores
et Frost & Franzen (1992) ont montré que leur modèle à l’état stationnaire
ne reproduisait les caractéristiques de la dynamique du phytoplancton
observées in situ que lorsque deux niveaux de carnivores étaient
considérés. Le fonctionnement
du réseau trophique dépend donc de l’équilibre entre le contrôle par
les ressources et le contrôle par la prédation; l’importance relative
de ces contrôles est encore une question débattue (par exemple Longhurst,
1991; Banse, 1995; Franks, 2001; Marine Zooplankton Colloquium 2, 2001). La quantification
du contrôle de la dynamique de l’écosystème par la prédation, tant
par les herbivores que par les carnivores, apparaît centrale si l’on
veut interpréter les observations globales et intégrées et prédire
les biomasses phytoplanctoniques et leurs variations à différentes échelles
spatiales et temporelles. |
|
|
Au sein
du réseau trophique, on peut distinguer
schématiquement deux voies principales : la voie microbienne (pico-
et nanophytoplancton, bactéries, ciliés) et la voie macrobienne composée
d’organismes de grande taille (diatomées, copépodes, salpes,...). L’influence
principale de ces deux voies sur la pompe biologique du CO2 peut être
résumée en s’appuyant sur Longhurst (1991) qui a divisé schématiquement
la pompe biologique en trois processus écologiques : (1) une pompe
rotative (rotary pump) qui correspond à la circulation et à la rétention
de la matière dans la zone euphotique sous l’action du réseau microbien,
(2) une pompe d’Archimède (Archimedian pump) qui correspond au flux
vertical de particules (pelotes fécales, agrégats, coquilles calcifiées,...)
produites par le réseau macrobien, (3) une pompe alternative (reciprocating
pump) représentée par les organismes migrateurs.
Le
réseau microbien est ubiquiste en milieu marin et les nombreuses études
qui lui ont été consacrées ces vingt dernières années ont considérablement
augmenté notre connaissance des flux de matière et d’énergie dans
les couches superficielles (Azam, 1998). Les bactéries jouent un rôle essentiel
dans le réseau trophique par leur capacité à assimiler et reminéraliser
la matière organique détritique et/ou dissoute (MO). Ce sont en effet
les rares organismes capables de récupérer des concentrations extrêmement
faibles de molécules organiques dispersées dans le milieu sous forme
dissoute et/ou colloïdale. La respiration d'une partie de ces substrats
en CO2 s'accompagne de la remise à disposition des sels
minéraux à l'ensemble du réseau trophique. La fraction assimilée produit
une biomasse bactérienne à la base du réseau trophique; cette biomasse
est utilisée par le nano- et le microzooplancton qui sont à leur tour
la proie du zooplancton macrobien. Une fraction de la MO qui, sans l'intervention
bactérienne serait perdue pour le système, est ainsi réinjectée dans
le réseau trophique. Si de nombreux travaux montrent que la concentration
et la composition élémentaire des substrats sont des paramètres importants
dans la régulation de la dynamique bactérienne (cf. Touratier et al.,
2001), les substrats considérés sont le plus souvent de petites molécules
organiques. Ainsi, la relation MO-bactéries est
encore définie de façon peu précise. Une grande partie de la MO, qu'il
s'agisse de détritus planctoniques, de pelotes fécales ou d'exsudats
frais, se trouve dans le milieu sous forme de biopolymères de grande
taille. En effet, seules les molécules de faible poids moléculaire
(<600) sont directement accessibles aux bactéries. C'est l'hydrolyse
par les ecto-enzymes bactériennes qui réalise le clivage des biopolymères
en monomères assimilables. Allant à l'encontre de cette mise à disposition
des polymères et des monomères, différents processus, tels que condensations
chimiques, protection physique par une fraction minérale ou agrégations
biologiques, par le zooplancton notamment, entraînent la néoformation
de molécules plus ou moins accessibles aux enzymes bactériennes, à partir
de la MO biogène (Carlson et al., 1985; Amon & Benner, 1994; Amstrong
et al., 2002). L’efficacité de minéralisation du
réseau microbien ne peut donc être comprise et estimée qu'à partir
d’une approche pluridisciplinaire tenant compte à la fois de la variabilité des
caractéristiques chimiques de la matière organique et de la diversité des
espèces bactériennes et de leurs fonctionnalités. Cette relation diversité/fonctionnalité des
communautés bactériennes est aujourd’hui un enjeu majeur pour l'étude
de l’impact des processus bactériens dans les flux de matière et d'énergie
(Cottrell & Kirchman, 2000a). Enfin, la minéralisation s'exerce à tous
les niveaux de la colonne d'eau, depuis la surface jusqu'en profondeur.
La spécificité des milieux méso- et bathypélagique doit donc être intégrée à l'étude
de ce processus.
Cette "pompe
rotative", gouvernée par le réseau microbien, est étroitement
liée à la “pompe d’Archimède” et à la “pompe alternative” dont la signification
potentielle nécessite une meilleure compréhension de la structure et du fonctionnement du réseau macrobien.
Le zooplancton
macrobien présente une grande diversité structurelle et fonctionnelle.
Le rapport de taille entre prédateur et proie montre une très grande
variabilité chez le zooplancton macrobien (Longhurst, 1991; Fortier
et al., 1994). Par exemple, certains organismes, tels que les crustacés
(copépodes, euphausiacés) sont capables de se nourrir sur les grandes
cellules phytoplanctoniques (diatomées) qui ne sont pas accessibles
au microzooplancton. Par contre, certains groupes d’organismes gélatineux,
tels que salpes, appendiculaires et mollusques ptéropodes, exploitent
efficacement le nanophytoplancton et sont donc en compétition avec
le microzooplancton. D’autre part,
les niveaux trophiques ne se limitent pas aux herbivores et carnivores
stricts, mais comprennent aussi des omnivores et des détritivores,
d’où l’abandon du concept de chaîne trophique au profit de celui de
réseau trophique. Si la diversité du zooplancton macrobien est reconnue,
la structure de l’écosystème et la succession des espèces dominantes
sont encore peu prises en compte dans la prédiction des flux de carbone. Le zooplancton
macrobien est aussi à l’origine de la majorité des grandes particules
exportées en profondeur. Ce flux contrôle le cycle des éléments chimiques
mais il fournit aussi la quasi-totalité de l'apport énergétique à la
faune des grands fonds (e.g. Coale & Bruland, 1985; Fowler & Knauer,
1986). Ces particules, telles les pelotes fécales des salpes, peuvent
présenter des vitesses de sédimentation très élevées. Elles sont produites à toutes
les profondeurs, avec en particulier une remobilisation du matériel
détritique par différents types d’organismes zooplanctoniques. Une fraction
de la matière produite en surface est également transportée en profondeur
de manière active par les migrateurs et cette exportation est assurée
principalement par les organismes de grande taille. L'effet de cette
migration verticale nycthémérale du zooplancton sur la dynamique de
l'écosystème et les flux de matière organique et inorganique est encore
mal quantifié, bien que son importance soit largement reconnue (e.g.
Angel, 1989; Longhurst, 1991; Banse, 1995; Marine Zooplankton Colloquium
2, 2001). La composition
spécifique du réseau trophique, à tous ses échelons, est donc un facteur
déterminant l’efficacité de la pompe biologique du CO2. |
|
|
La plus grande
partie de la matière organique synthétisée par les producteurs primaires
dans la couche euphotique est recyclée dans la zone épipélagique à travers
les réseaux trophiques dynamiques et seulement quelques % de cette
matière est exportée au-delà de 1000 m (Lampitt & Antia, 1997).
Or seule cette fraction de la matière organique entraînée vers les
eaux profondes soustrait du CO2 à l'atmosphère à long ou
moyen terme (Ittekott et al. 1996). Les particules
les plus denses, dont la densité leur permet franchir les gradients
physiques des eaux superficielles et de la colonne d'eau, constituent
la majeur partie du flux particulaire. Les organismes intacts peuvent
représenter jusqu'à 50% de ce flux qui comprend également des pelotes
fécales d'origine zooplanctonique et des agrégats de différentes sources
et tailles. Ces agrégats constituent des micro-environnements très
réactifs associant bactéries endogènes et MO. Ainsi les caractéristiques à l’échelle
particulaire, en terme de MO et de diversité des bactéries (auxquelles
vient s’ajouter la présence de nanoflagellés et de ciliés hétérotrophes)
peuvent déterminer le rôle spécifique des bactéries et du zooplancton
dans les vitesses de sédimentation et le contrôle du flux particulaire.
Le flux particulaire constitue aussi un des rares apports de détritus
phytoplanctoniques au sédiment profond. D'autre part,
la convexion des masses d'eau entraîne en profondeur la fraction du
carbone organique biogène non assimilée dans le réseau trophique et
accumulée en surface sous forme dissoute. Une fraction de cette MO
rejoint le flux particulaire par adsorption et ré-agrégation. Enfin,
une fraction perd sa biodisponibilité par transformation en molécules
plus réfractaires. Il est donc indispensable
de bien comprendre la dynamique du flux particulaire à l'aide d'outils
nouveaux, pour mieux contraindre les flux biologiques actuels. La connaissance
des flux "modernes" et des outils de leur traçabilité peut
trouver des applications dans l'identification des processus biogéochimiques "anciens". Les marqueurs
organiques ont par définition la capacité de conserver les signaux
des sources et transformations subies par la matière organique biogène
jusqu’à sa minéralisation ou sa préservation. C’est ce qui leur confère
la possibilité de décrire et comprendre les flux majeurs d’échanges
entre les réservoirs de l’atmosphère, l’océan et le sédiment (Wakeman & Lee,
1993). Au sein du réseau trophique, ces marqueurs ont pour origine
les bio-polymères des cellules vivantes et des détritus. La mise à disposition
des bio-polymères à des systèmes enzymatiques plus ou moins diversifiés
du réseau trophique va, comme nous l’avons vu, préluder à l’assimilation
et à la respiration bactériennes. Les processus de dissolution, re-condensation
ou bien agrégation particulaire influencent largement le flux d’exportation,
en accélérant la mise à disposition des bio-polymères ou au contraire
en les protégeant de l’action des ecto-enzymes (dont l'activité est
par ailleurs mesurable). Ainsi l'étude
du comportement de marqueurs organiques doit inclure la mesure de la
vitesse réelle de la production de leur métabolites de dégradation
dans le milieu par les ecto-enzymes bactériennes, de leur assimilation
par les bactéries et/ou de leur accumulation dans le milieu. Cette
approche constitue une démarche biogéochimique nouvelle, conciliant
les approches des microbiologistes et des géochimistes. Elle peut être
appliquée à différents modèles moléculaires tels que les lipides de
type glycéryl-esters, leurs métabolites (les acides gras), les activités
lipolytiques et les lipases. |
|
|
Dans l’océan, les structures
physiques et les structures biologiques varient dans une large gamme
d’échelles temporelles et spatiales (e.g. Haury et al., 1978). Il est
fondamental de comprendre le couplage entre les échelles, des plus
petites aux plus grandes, et d’en quantifier les conséquences. Au cours
des quinze dernières années, les océanographes ont progressivement
pris conscience de l’importance des processus se déroulant aux petites échelles
de temps (Marine Zooplankton Colloquium 1, 1989; Platt et
al., 1989; Longhurst, 1991). Les réponses du système aux perturbations transitoires sont
souvent complexes et non-linéaires. Des bilans
fiables sur le long terme ne peuvent être calculés si l’on manque
de données sur les variances et covariances à petite échelle de temps,
en particulier aux échelles de quelques heures à quelques jours. En régime océanique,
les augmentations épisodiques de la biomasse phytoplanctonique représentent
une fraction importante de la production primaire annuelle (Platt et
al., 1989) et donc de l’exportation de matière organique vers le fond
des océans. Les mélanges turbulents induits par le vent sont un exemple
d’événements épisodiques qui peuvent modifier la dynamique et la composition
de l’écosystème pélagique. Cette turbulence peut induire des transports
impulsionnels de sels nutritifs profonds vers la couche euphotique,
une augmentation de la biomasse et de la production phytoplanctonique,
des variations de composition des communautés phyto- et zooplanctonique,
et une stimulation des flux verticaux de particules biogéniques (e.g. Haury et al., 1990; Marra et al., 1990; Kiørboe, 1993). Les
flux verticaux de particules biogéniques sont aussi stimulés par d’autres
phénomènes transitoires, tels que le développement rapide d’essaims
de salpes (filtreurs gélatineux) qui sont capables de consommer le
stock de petites cellules phytoplanctoniques et produisent de grandes
pelotes fécales sédimentant à vitesse élevée.
D’autre part, les périodes de transition saisonnière,
qui caractérisent les zones tempérées, paraissent particulièrement
critiques car elles conditionnent
la variabilité interannuelle. Ces périodes apparaissent gouvernées
par la combinaison et la succession de processus rapides, de l’ordre
de quelques heures à quelques jours. Leur étude doit être menée sur
plusieurs semaines consécutives afin de bien appréhender l’effet de
ses interactions et couplages, en particulier sur la succession des
espèces dominantes qui peut être brutale ou progressive. Par exemple, les observations à haute fréquence réalisées
sur une période d’un mois dans la zone centrale de la mer Ligure
pendant la campagne DYNAPROC (mai 1995) ont permis de saisir
l’impact de coups de vent sur la dynamique de l’écosystème à l’échelle
de quelques heures à quelques jours, mais aussi leur répercussion
sur la transition saisonnière de la mésotrophie à l’oligotrophie.
Cet impact a été observé sur l’évolution de divers paramètres et
processus, tels que (1) la structure hydrologique et chimique dans
la couche euphotique avec, en particulier, un changement de l’élément
nutritif limitant la croissance du phytoplancton et du rapport d’utilisation
entre le carbone, l’azote et l’oxygène, (2) les biomasses, compositions
et distributions verticales du phytoplancton et du zooplancton, (3)
les activités bactériennes, avec une évolution dans l'utilisation
de ressources carbonées soit sous forme dissoute soit sous forme
particulaire, et (4) le stock de particules en suspension, leur temps
de résidence dans la couche euphotique, l’amplitude et la composition
du flux vertical de matière (Schmidt et al., 1997; Andersen & Prieur,
2000; Copin-Montégut, 2000; Goutx et al., 2000; Pérez et al., 2000;
Stemmann et al., 2000; Vidussi et al., 2000; Andersen et al., 2001a;
Van Wambeke et al., 2001). Les perturbations transitoires qui ont
eu lieu pendant la campagne ont d’abord retardé la diminution de
la biomasse phytoplanctonique et donc l’évolution du système vers
l’oligotrophie, puis cette diminution a été accélérée sous l'effet
d'interactions complexes entre la disponibilité en sels nutritifs,
la composition de la communauté phytoplanctonique et le broutage
du zooplancton. Le modèle 1-D couplé physique-biologie appliqué aux
données de la campagne a montré que les contributions des processus
physiques et des processus biologiques à la variation locale de la
biomasse du phytoplancton étaient du même ordre de grandeur (Chifflet
et al., 2001). Ces observations
montrent la nécessité d’intégrer à l'échelle saisonnière, voire interannuelle,
les différents processus physiques, chimiques et biologiques de régulation
se produisant à de petites échelles spatio-temporelles et leur transfert à l’ensemble
de la colonne d'eau. Ce type d’étude est indispensable pour établir
un schéma cohérent de la relation entre la production biologique de
surface et le flux d’exportation en profondeur dont dépend l'apport
de matière organique au sédiment. |
|
"Références citées
dans le
texte
Alldredge, A.L., Passow, U. & B.E. Logan, 1993. The abundance and significance of a class of large, transparent organic particles in the ocean. Deep-Sea Res. II 40, 1131-1140 Amann, R.I., Ludwig, W. & K.H. Schleifer
, 1995. Phylogenetic
identification and in situ detection of individual microbial cells without
cultivation. Microbiol. Rev. 59,143-169. Amon R. M. W. & R. Benner, 1994. Rapid
cycling of high-molecular-weight dissolved organic matter in the ocean.
Nature 369, 549-552. Amstrong, R. A., Lee, C., Hedges, J. I.
, Honjo, S. & S. Wakeham.
Mineral ballast fluxes determine organic carbon fluxes to the deep ocean
and sediments. Nature
(en révision). Andersen, V. & L. Prieur, 2000. One-month study in the open NW Mediterranean
Sea (DYNAPROC experiment, May 1995): Overview of hydrobiogeochemical
structures and effects of wind events. Deep-Sea Res. I 47, 397-422. Andersen, V., Nival, P., Caparroy, P. & A.
Gubanova, 2001a. Zooplankton community during the transition from spring
bloom to oligotrophy in the open NW Mediterranean and effects of wind
events. 1 - Abundance and specific composition. J. Plankton Res. 23,
227-242. Andersen, V., Gubanova, A., Nival, P. & T.
Ruellet, 2001b. Zooplankton community during the transition from spring
bloom to oligotrophy in the open NW Mediterranean and effects of wind
events. 2 - Vertical distributionsand migrations. J. Plankton Res. 23,
243-261. Angel, M.V., 1989. Does mesopelagic biology
affect the vertical flux? In, Productivity of the Ocean: Present and Past, Berger, W. H., Smetacek, V. S. & Wefer,
G. (eds.). John Wiley & Sons Limited, pp. 155-173. Azam F., 1998. Microbial control of oceanic
carbon flux : The plot thickens. Science 280, 694-696. Banse, K., 1994. Grazing and zooplankton production as
key controls of phytoplankton production in the open ocean. Oceanography 7, 13-20. Banse, K., 1995. Zooplankton: Pivotal role in the control of
ocean production. ICES J. mar. Sci. 52, 265-277. Becquevort S. & W.O. Smith Jr, 2001. Aggregation, sedimentation and biodegradability of phytoplankton-derived
material during spring in the Ross Sea, Antarctica. Deep-Sea Res II 48,
4155-4178. Benitez-Nelson, C., Buesseler, K.O., Karl,
D.M. & J. Andrews, 2001. A time-series study of particulate matter
export in the North Pacific Subtropical Gyre based on 234Th: 238U
disequilibrium. Deep-Sea Res. I 48, 2595-2611. Buesseler, K.O., 1998. The decoupling
of production and particulate export in the surface ocean. Global Biogeochemical
Cycles 12, 297-310. Caillau, C., Belviso, S., Goutx, M. & A.
Bedo,, 1999. Particles flux in the Southern Ocean during Austral summer.
Mar. Ecol. Prog. Ser., 190 : 53-67 Carlson, D. J., Mayer, L. M., Brann, M.
L., & T. H. Mague, 1985. Binding of monomeric organic compounds to
macromolecular dissolved organic matter in sea water. Mar. Chem. 16:
141-153. Cauwet, G., 1994. HTCO method for dissolved
organic carbon analysis in seawater : influence of catalyst on blank
estimatiion. Mar. Chem. , 47 : 55-64. Chiarini, C., 1993. Micronecton et macroplancton en mer Ligure
(Méditerranée) : Distributions verticales et migrations nycthémérales
en automne. Université de Gênes, Rapport de Stage de Recherches post-maîtrise. Chifflet, M., Andersen, V., Prieur, L. & I.
Dekeyser, 2001. One-dimensional model of short-term dynamics of the pelagic
ecosystem in the NW Mediterranean Sea: effects of wind events. J. mar. Systems 30, 89-114. Christaki, U. & F. van Wambeke, 1995. Simulated bloom input in top-down manipulated
microcosms : comparative effect of zooflagellates, ciliates and copepods.
Aquat. Microbial Ecol. 9, 137 – 147. Chróst, R.J. (ed.), 1991. Microbial Enzymes
in Aquatic Environments. Brock T.D. (Pub.), New York, 317 pp. Coale, K.H. & K.W. Bruland, 1985. 234Th:238U
disequilibria within the California Current. Limnol. Oceanogr. 30, 22-33. Copin-Montégut, C., 2000. Consumption and production on scales of
a few days of inorganic carbon, nitrate and oxygen by the planktonic
community. Results of continuous measurements at the Dyfamed Station
in the northwestern Mediterranean Sea (May 1995). Deep-Sea Res. I 47,
447-477. Cottrell, M. & D. Kirchman, 2000a.
Natural assemblages of marine proteobacteria and members of the Cytophaga – Flavobacter
cluster consuming low- and high molecular weight dissolved organic matter,
Appl. Environ. Microbiol. 66 : 4, 1692-1697. Cottrell, M.T. & D.L. Kirchman, 2000b. Community composition of marine bacterioplankton
determined by 16S rRNA gene clone libraries and fluorescence in situ hybridisation. Appl. Env. Microbiol. 66, 5116-5122. Delbès, C, Moletta, R. & J.J. Godon,
2000. Monitoring of activity dynamics of an anaerobic digester bacterial
community using 16S rRNA polymerase chain reaction—single-strand conformation
polymorphism analysis. Environ Microbiol. 2, 506-515. Dolan, J.R., 2000. Tintinnid ciliate diversity in the Mediterranean Sea:
longitudinal patterns related to water column structure in late spring-early
summer. Aquat. Microb. Ecol. 22,69-78. Fortier, L., Le Fèvre, J. & Legendre, L., 1994. Export of biogenic carbon to fish and to the deep ocean:
the role of large planktonic microphages. J. Plankton
Res. 16, 809-839. Fowler, S.W. & G.A. Knauer, 1986. Role of large particles in the transport of elements
and organic compounds through the oceanic water column. Prog. Oceanogr. 16, 147-194. Franks, P.J.S., 2001. Phytoplankton blooms in fluctuating environment:
the roles of plankton response time scales and grazing. J. Plankton
Res. 23, 1433-1441. Franqueville, C., 1971. Macroplancton
profond (invertébrés) de la Méditerranée nord-occidentale. Tethys
3, 11-56. FRONTAL, 1989. Résultats des missions "FRONTAL". Tome I:1984-1985. Tome II:1986-1988. Rapport interne, Villefranche-sur-mer, France. Frost, B.W. & Franzen, N.C., 1992. Grazing and iron limitation in the control of phytoplankton
stock and nutrient concentration: a chemostat analogue of the Pacific
equatorial upwelling zone. Mar. Ecol. Prog. Ser. 83, 291-303. Gaspar, P., Grégoris, Y. & J.-M. Lefevre, 1990. A simple eddy kinetic energy model for simulations of
the oceanic vertical mixing: Tests at station Papa and long-term upper
ocean study site. J. Geophys.
Res. 95, 16179-16193. Gonzalez, J.M., Simo, R., Massana,R.,
Covert, J.S., Casamayor, E.O., Pedros-Alio, C. & M. Ann Moran, 2000.
Bacterial community structure associated with a dimethylsulfoniopropionate-producing
North Atlantic algal bloom. Appl. Environ. Microbiol. 66, 4237-4246. Gorsky, G., Flood, P.R., Youngbluth, M.J.,
Picheral, M. & J.-M. Grisoni, 2000. Zooplankton Distribution in Four
Western Norwegian Fjords. Estuar. Coast. Shelf Sci.
50, 135-141. Goutx, M., Momzikoff, A., Striby, L.,
Andersen, V., Marty, J.-C. & I. Vescovali, 2000. High frequency fluxes
of labile compounds in the central Ligurian Sea, northwestern Mediterranean.
Deep-Sea Res. I 47, 533-556. Goyet, C. & S.D. Hacker, 1992. Procedure
for calibration of a coulometric system used for total inorganic carbon
measurements of seawater. Mar. Chem.
38, 37-51. Grégori, G., Citterio, S., Ghiani, A., Labra, M., Sgorbati, S. & M.
Denis, 2001. Resolution of viable and membrane-compromised bacteria in fresh water
and marine waters based on analytical flow cytometry and nucleic acid
double staining. Appl. Environ. Microbiol. 67, 4662-4670. Haury, L.R., McGowan, J.A. & Wiebe, P.H., 1978. Patterns and processes in time-space scales
of plankton distributions. In, Spatial pattern in plankton communities,
Steele, J. H. (ed.). Plenum Press, New York, pp. 277-327. Haury, L.R., Yamazaki, H. & E.C. Itsweire,
1990. Effects of turbulent shear
flow on zooplankton distribution. Deep-Sea
Res. 3, 447-461. Ittekott,V., Schõfer, P. Honjo, S., Depetris,
P.J.,(eds), 1996. Particule flux in the ocean, Scope 57. Wiley, New York. Jürgens K. & H. Güde, 1994. The potential importance of grazing-resistant
bacteria in planktonic systems. Mar. Ecol. Prog. Ser. 112, 169-188. Karner M. & G.J. Herndl, 1992. Extracellular
enzymatic activity and secondary production in free-living and marine-snow-associated
bacteria. Mar Biol 113, 341-347. Kieber, R.J., Hydro, L.H. & P.J. Seaton,
1997. Photooxidation of triglycerides and fatty acids in seawater: Implication
toward the formation of marine humic substances. Limnol. Oceanogr. 42, 1454-1462. Kiørboe, T., 1993. Turbulence, phytoplankton cell size, and the structure
of pelagic food webs. Adv. Mar. Biol. 29, 1-72. Klein, P. & B. Coste, 1984. Effects of wind stress variability on nutrient transport
into the mixed layer. Deep-Sea
Res. 31, 21-37. Klug, M.J. & J.M. Tiedje, 1993. Response of microbial communities to changing
environmental conditions : chemical and physiological approaches. In,
Trends in microbial ecology. R. Guerrero & C. Pedros-Alio (eds.),
pp. 371-386. Kuznetsova, M. & C. Lee, 2001. Enhanced extracellular enzymatic peptide
hydrolysis in the sea-surface microlayer. Mar. Chem.
73, 319-332. Lacroix, G., 1998. Etude de la variabilité saisonnière et interannuelle
d’un écosystème en Mer Ligure à l’aide d’un modèle couplé physique/biologie.
Thèse de Doctorat en Sciences de l’Université de Liège et Thèse de Doctorat
de l’Université Paris VI (Océanologie Biologique et Environnement Marin). Lacroix, G. & P. Nival, 1998. Influence of meteorological variability
on primary production dynamics in the Ligurian Sea (NW Med Sea) with
a 1D hydrodynamic/biological model. J. mar. Systems 16, 23-50. Lagadeuc, Y., Boulé, M. & J.J. Dodson,
1997. Effect of vertical mixing on the vertical distribution of copepods
in coastal waters. J. Plankton Res. 19, 1183-1204. Lampitt, R.S. & A.N. Antia, 1997.
Particle flux in deep seas: Regional characteristics and temporal variability.
Deep-Sea Res. I 44, 1377-1403. Langdon, C., 1984. Dissolved oxygen monitoring
system using a pulsed electrode design performance and evaluation. Deep-Sea
Res. Part A 31, 1357-1368. Lantoine, F. & J. Neveux, 1997. Spatial and seasonal variations in abundance
and spectral characteristics of phycoerythrins in the tropical Northeastern
Atlantic Ocean. Deep-Sea Res. I, 44, 223-246. Lebaron, P., Ghiglione, J.F. ,Fajon, C. & P.
Normand, 1998. Ecological implication of the diversity within a colony
morphotype as determined by PCR-RFLP. FEMS Microbiol.
Lett. 160, 137-143. Lévy, M., Mémery, L. & J.M. André, 1998. Simulation of primary production and export fluxes in
the Northwestern Mediterranean Sea. J. mar. Res. 56, 197-238. Long R.A. & F. Azam, 1996. Abundant
protein-containing particles in the sea. Aquat Microb Ecol 10, 213-221. Longhurst, A.R., 1991. Role of the marine biosphere in the global
carbon cycle. Limnol. Oceanogr. 36, 1057-1526. Marine Zooplankton Colloquium 1, 1989. Future
marine zooplankton research - a perspective. Mar.
Ecol. Prog. Ser. 55, 197-206. Marine Zooplankton Colloquium 2, 2001. Future
marine zooplankton research - a perspective. Mar.
Ecol. Prog. Ser. 222, 297-308. Marra, J., Bidigare, R.R. & T.D. Dickey,
1990. Nutrients and mixing, chlorophyll
and phytoplankton growth. Deep-Sea
Res. 37, 127-143. Martin, V., 1997. Etude par cytométrie en flux de la distribution
des populations phytoplanctoniques en Méditerranée. Mise en relation
avec la production métabolique de CO2 et comparaison avec
le Golfe du Saint Laurent. Thèse de Doctorat de l’Université de la Méditerranée. Marty, J.C., Chiavérini, J., Pizay, M.D. & B. Avril, 2002. Seasonal and interannual dynamics of nutrients
and phytoplankton pigments in the Western Mediterranean Sea at the DYFAMED
time-series station (1991-1999). Deep Sea Res. II 49 (12) (sous presse) Ohman, M.D., Drits, A.V., Clarke, M.E. & S. Plourde, 1998. Differential dormancy of co-occurring
copepods. Deep-Sea Res. II 45,
1709-1740. Palumbo, A.V., Ferguson, R.L. & P.A.
Rublee, 1984. Size of suspended bacterial cells and association of heterotrophic
activity with size fractions of particles in estuarine and coastal waters. Appl. Environ. Microbiol. 48, 157-164. Pérez, M.T., Dolan, J.R., Vidussi, F. & E. Fukai, 2000. Diel vertical distribution of planktonic
ciliates within the surface layer of the NW Mediterranean (May 1995).
Deep-Sea Res. I 47, 479-503. Platt, T., Harrison, W.G., Lewis, M.R., Li, W.K.W., Sathyendranath, S.,
Smith, R.E. & Vézina, A.F., 1989. Biological
production of the oceans : the case for a consensus. Mar. Ecol.
Prog. Ser. 52 , 77-88. Raimbault, P., Pouvesle, W., Sempéré, R., Diaz, F. & N. Garcia,
1999a. A simple
procedure for simultaneous analysis of total and dissolved organic forms
of carbon, nitrogen and phosphorus in seawater using the wet-oxidation
technic. Mar. Chem. 66, 161-169. Raimbault, P., Diaz, F. & B. Boudjellal,
1999b. Simultaneous determination of particulate forms of carbon, nitrogen
and phosphorus collected on filters using a semi-automatic wet-oxidation
procedure. Mar. Ecol. Progr. Ser. 180, 289-295. Raimbault P., Slawyk G., Boudjellal B.,
Coatanoan C., Conan P., Coste B., Garcia N., Moutin T. & M. Pujo-Pay,
1999c. Biomass, new production and export in the equatorial Pacific at
150°W: Evidence for intense nitrogen recycling. J. Geophys. Res. 104,
3341-3356. Raimbault P., Slawyk G. & N. Garcia,
2000. Comparison between chemical and isotopic measurements of biological
nitrate utilization: further evidence of low new production levels in
the equatorial Pacific. Mar. Biol., 136, 1147-115. Richardot M., Debroas, D., Thouvenot,
A., Romagoux, J.C., Berthon, J.L. & J. Devaux 1999. Proteolytic and
glycolytic activities in size-fractionated surface water samples from
an oilgotrophic reservoir in relation to plankton communities. Aquat.
Sci. 61, 279-292. Riemann, L., Steward, G.F. & F. Azam,
2000. Dynamics of bacterial community composition and activity during
a mesocosm diatom bloom. Appl. Environ. Microbiol. 66,
578-587. Sardou, J., Etienne, M. & Andersen, V., 1996. Seasonal abundance and vertical distributions of macroplankton
and micronekton in the Northwestern Mediterranean Sea. Oc. Acta 19, 645-656. Schmidt, S., Nival, P., Reyss, J.-L.,
Baker, M. & P. Buat-Ménard, 1992. Relation between Th-234 scavenging
and zooplankton biomass in Mediterranean surface waters. Oceanol. Acta
15, 227-231. Schmidt, S., Reyss, J.-L. & V. Andersen,
1997. Residence times of particles in NW Mediterranean surface waters
estimated from 234Th / 238U disequilibria. Radioprotection - Colloques, 32, C2, 177-181. Slawyk G. & P. Raimbault,1995. A simple procedure for the simultaneous recovery
of dissolved inorganic and organic nitrogen in 15N-tracer experiments
on oceanic waters improving the mass balance. Mar. Ecol. Prog. Ser. 124,
289-299. Slawyk, G., Raimbault, P. & N. Garcia,
2000. Use of 15N to measure dissolved organic nitrogen release
by marine phytoplankton (reply to comment by Bronk and ward). Limnol.
Oceanogr. 45, 1884-1886. Smith, D.C., Steward, G.F. Long, R.A. & F.
Azam, 1995. Bacterial mediation of carbon fluxes during diatom bloom
in a mesocosm. Deep Sea Res. II 42, 75-97. Steele, J.H. & Henderson, E.W., 1992. The
role of predation in plankton models. J.
Plankton Res. 14, 157-172. Stemmann, L., Picheral, M. & G. Gorsky,
2000. Diel changes in the vertical distribution of suspended particulate
matter in the NW Mediterranean Sea investigated with the Underwater Video
Profiler. Deep-Sea Res. I 47, 505-531. Tamburini C., Garcin J., Ragot M. & A.
Bianchi A., 2002. Biopolymer hydrolysis and bacterial production under
ambient hydrostatic pressure through a 2000 m water column in the NW
Mediterranean. Deep-sea Res. II, 49 (12) (sous presse). Touratier, F., Field, J. & C. Moloney,
2001. A stochiometric model relating growth substrate quality (C:N:P
ratios) to N:P ratios in the poducts of heterotrophic release and excretion. Ecol. Model. 139, 265 – 291. Tréguer, P. & P. Le Corre, 1975, Manuel d'analyse des sels
nutritifs dans l'eau de mer (Utilisation de l'AutoAnalyser II Technicon&). Brest, Laboratoire
d'Océanographie Chimique, Rapport interne, 110 pp. Van Wambeke, F., Goutx, M., Striby, L.,
Sempéré, R. & F. Vidussi, 2001. Bacterial
dynamics during the transition from spring bloom to oligotrophy in the
northwestern Mediterranean Sea: relationships with particulate detritus
and dissolved organic matter. Mar. Ecol.
Prog. Ser 212, 89-105. Veldhuis M.J.W., Kraay G.W & K. Timmermans,
2001. Cell
death in phytoplankton: correlation between changes in membrane permeability,
photosynthetic activity, pigmentation and growth. J. Phycol. 36, 167-177. Verity, P.G. & Smetacek, V., 1996. Organism
life cycles, predation, and the structure of marine pelagic ecosystems. Mar. Ecol. Prog. Ser. 130, 277-293. Vidussi F., Claustre H., Bustillos-Guzman
J., Cailliau C. and J.C. Marty, 1996. Rapid HPLC method for determination
of phytoplankton chemotaxonomic pigments: separation of chlorophyll a
from divinyl chlorophyll a and zeaxanthin from lutein. J.
Plankton Res. 18, 2377-2382. Vidussi, F., Marty, J.-C. & J. Chiavérini,
2000. Phytoplankton pigment variations during the transition from spring
bloom to oligotrophy in the Mediterranean Sea. Deep-Sea Res. I 47, 423-445. Wakeham, S. G., & C. Lee, 1993. Production,
transport, and alteration of particulate organic matter in the marine
watercolumn. In : (M.H. Engel and S.A. Macko, Eds) Organic Geochemistry,
principles and applications, 145-169. Weeks, A., Conte, M. H., Harris, R. P.,
Bedo, A., Bellan, I., Burkill, P. H., Edwards, E. S., Harbour, D. S.,
Kennedy, H., Llewellyn, C., Mantoura, R.F.C., Morales, C. E., Pomroy,
A. J., & C. M. Turley, 1993. The physical and chemical environment
and changes in communauty structure associated with bloom evolution:
the Joint Global Flux Study North Atlantic Bloom Experiment. Deep-Sea
Research II, 40, 347-368. Williams P.J. LEB. & N.W. Jenkinson,
1982. A transportable microprocessor-controlled precise Winkler titration
suitable for field station and shipboard use. Limnol.
Oceanogr. 27, 576-585. |
|